_____________________ __________________ __________________ М.П.
(должность) (Ф.И.О.) (подпись)
Перечень (опись) приложенных к заявлению документов:
N | Наименование документа | Количество страниц |
1 | Проекты макетов первичной упаковки и вторичной (потребительской) упаковки лекарственного препарата | |
2 | Документ, переведенный на русский язык, подтверждающий соответствие производителя регистрируемого лекарственного препарата требованиям правил организации производства и контроля качества лекарственных средств, выданный компетентным органом страны производителя регистрируемого лекарственного препарата и заверенный в установленном порядке | |
3 | Проект нормативной документации на лекарственный препарат либо указание соответствующей фармакопейной статьи | |
4 | Схема технологического процесса производства лекарственного препарата, ее описание и (или) схема технологического процесса производства фармацевтической субстанции, ее описание | |
5 | Документ, переведенный на русский язык, подтверждающий соответствие производителя фармацевтической субстанции требованиям правил организации производства и контроля качества лекарственных средств, выданный компетентным органом страны производителя фармацевтической субстанции, заверенный в установленном порядке | |
6 | Документ, содержащий сведения о показателях качества фармацевтической субстанции, используемой при производстве лекарственных препаратов | |
7 | Нормативная документация на фармацевтическую субстанцию либо указание соответствующей фармакопейной статьи | |
8 | Информация об условиях хранения, перевозки лекарственного препарата и иная информация | |
9 | Отчет о результатах доклинического исследования лекарственного средства для медицинского применения, содержащий описание, результаты и статистический анализ результатов данного доклинического исследования | |
10 | Проект протокола клинического исследования лекарственного препарата для медицинского применения | |
11 | Брошюра исследователя | |
12 | Информационный листок пациента | |
13 | Информация о выплатах и компенсациях пациентам (здоровым добровольцам, больным) (далее - пациенты), привлеченным к проведению клинических исследований лекарственного препарата для медицинского применения, исследований биоэквивалентности и (или) терапевтической эквивалентности | |
14 | Отчет о результатах международных многоцентровых клинических исследований лекарственного препарата для медицинского применения, часть из которых проведена на территории Российской Федерации | |
15 | Проект инструкции по применению лекарственного препарата | |
16 | Переведенная на русский язык и заверенная в установленном порядке копия документа, подтверждающего регистрацию лекарственного препарата в случае его регистрации вне пределов Российской Федерации | |
17 | По желанию заявителя могут быть представлены отчеты о проведенных в стране заявителя и других странах результатах клинических исследований, исследований биоэквивалентности и (или) терапевтической эквивалентности лекарственного препарата (включая эпидемиологические или эпизоотологические исследования иммунобиологических лекарственных препаратов, предназначенных для иммунологической профилактики и лечения инфекционных заболеваний, в том числе у детей), содержащие описания проведенных исследований лекарственного препарата, их результаты и статистический анализ полученных результатов |
Заявление о государственной регистрации лекарственного препарата для
медицинского применения, представил:
_____________________ __________________ __________________ М.П.
(должность) (Ф.И.О.) (подпись)
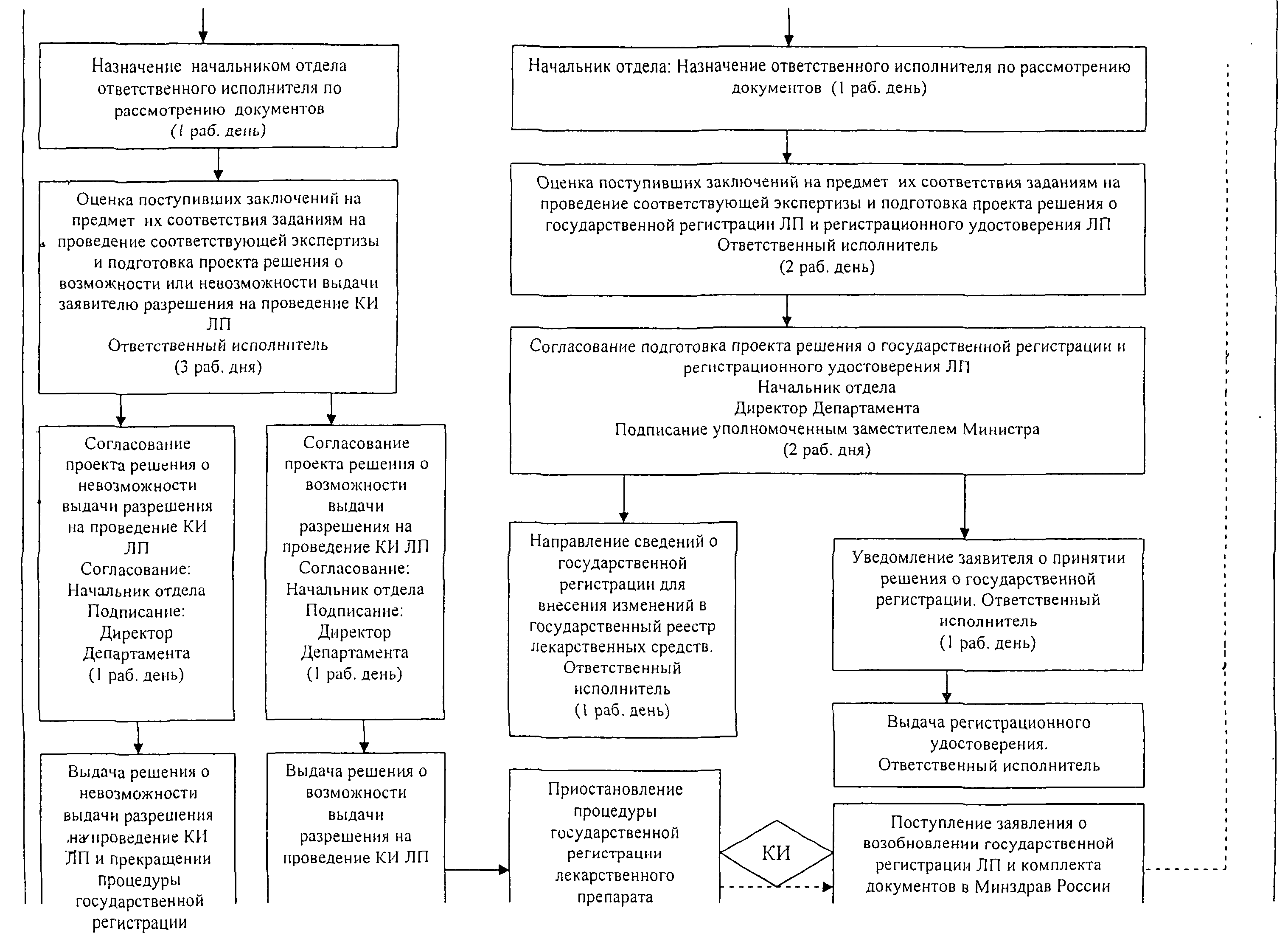
Приложение N 2
к Административному регламенту
по предоставлению государственной
услуги по государственной регистрации
лекарственных препаратов для
медицинского применения
утв. приказом Министерства здравоохранения РФ
от 22 октября 2012 г. N 428н
к Административному регламенту
по предоставлению государственной
услуги по государственной регистрации
лекарственных препаратов для
медицинского применения
утв. приказом Министерства здравоохранения РФ
от 22 октября 2012 г. N 428н
 | |
| 3010 × 1879 пикс. Открыть в новом окне | |
 | |
| 3045 × 2187 пикс. Открыть в новом окне | |
 | |
| 3035 × 2238 пикс. Открыть в новом окне | |
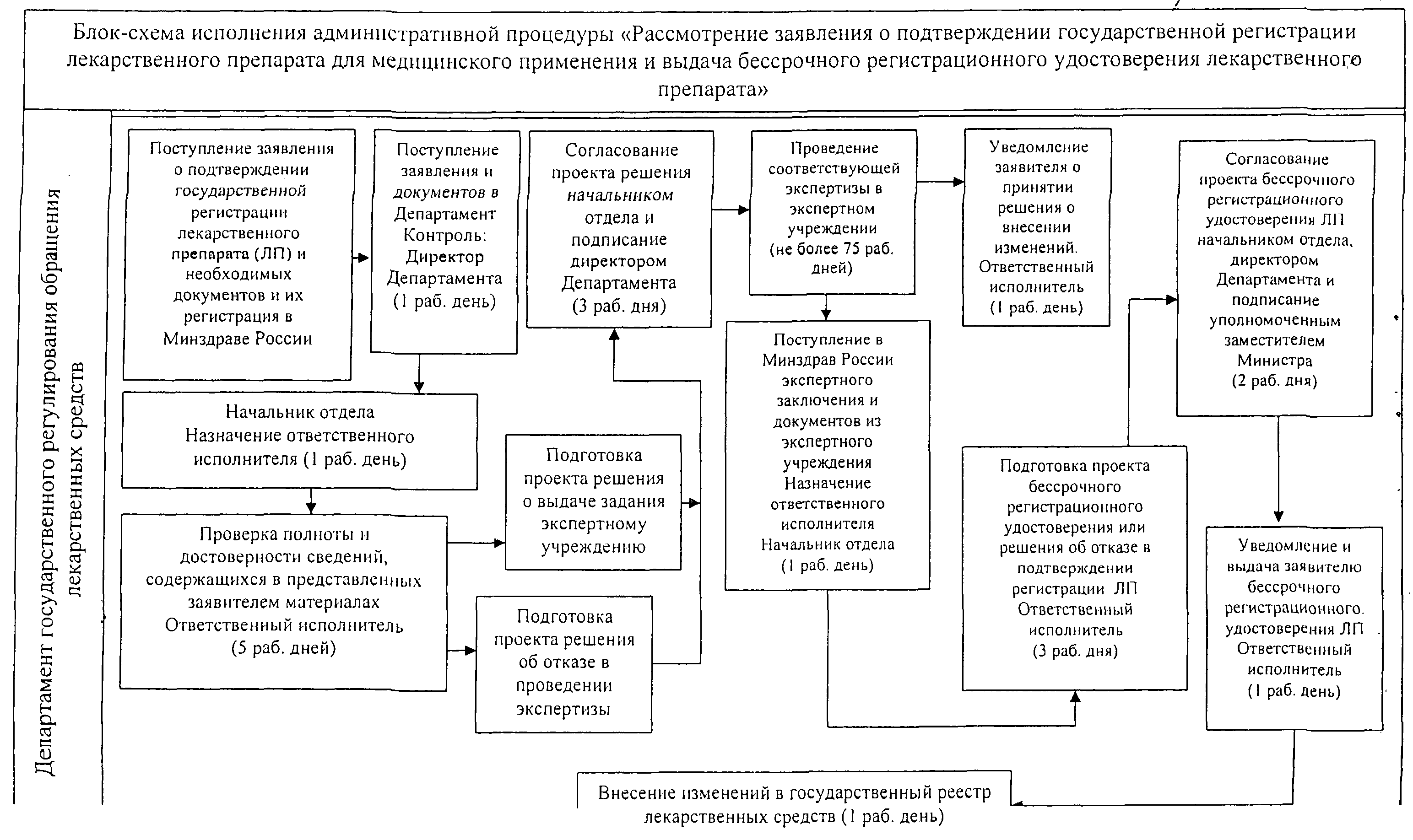
Приложение N 3
к Административному регламенту
по предоставлению государственной
услуги по государственной регистрации
лекарственных препаратов для
медицинского применения
утв. приказом Министерства здравоохранения РФ
от 22 октября 2012 г. N 428н
к Административному регламенту
по предоставлению государственной
услуги по государственной регистрации
лекарственных препаратов для
медицинского применения
утв. приказом Министерства здравоохранения РФ
от 22 октября 2012 г. N 428н
 | |
| 3087 × 1836 пикс. Открыть в новом окне | |
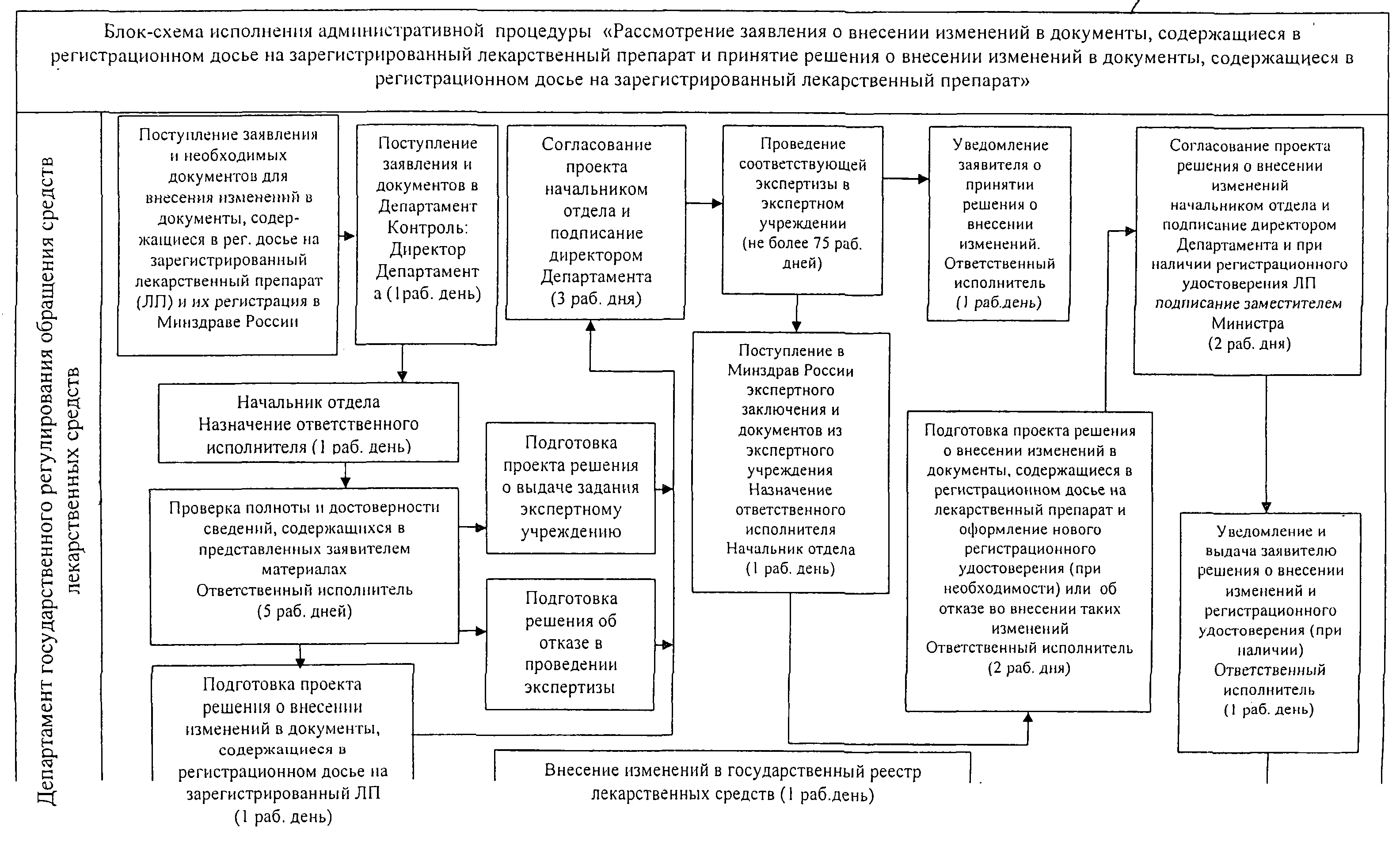
Приложение N 4
к Административному регламенту
по предоставлению государственной
услуги по государственной регистрации
лекарственных препаратов для
медицинского применения
утв. приказом Министерства здравоохранения РФ
от 22 октября 2012 г. N 428н
к Административному регламенту
по предоставлению государственной
услуги по государственной регистрации
лекарственных препаратов для
медицинского применения
утв. приказом Министерства здравоохранения РФ
от 22 октября 2012 г. N 428н
 | |
| 3168 × 1931 пикс. Открыть в новом окне | |
Приложение N 5
к Административному регламенту
по предоставлению государственной
услуги по государственной регистрации
лекарственных препаратов для
медицинского применения
утв. приказом Министерства здравоохранения РФ
от 22 октября 2012 г. N 428н
к Административному регламенту
по предоставлению государственной
услуги по государственной регистрации
лекарственных препаратов для
медицинского применения
утв. приказом Министерства здравоохранения РФ
от 22 октября 2012 г. N 428н
 | |
| 3052 × 1852 пикс. Открыть в новом окне | |
