3.7. Административная процедура "Ведение базы данных выданных разрешений на применение новых медицинских технологий" осуществляется в связи с выполнением административных процедур "Рассмотрение документов и принятие решения о выдаче разрешения на применение новой медицинской технологии", "Внесение изменений в разрешение на применение новой медицинской технологии", "Рассмотрение фактов и обстоятельств, создающих угрозу для жизни и здоровья людей при применении разрешенных новых медицинских технологий" и "Осуществление контроля за порядком проведения клинических и биомедицинских исследований новой медицинской технологии, а также ее использованием" настоящего Регламента в соответствии с нижеследующим порядком (схема осуществления административной процедуры приведена в Приложении 7):
3.7.1. Электронная база данных выданных разрешений на применение новых медицинских технологий ведется в отделе, осуществляющем выдачу разрешений на применение новых медицинских технологий Федеральной службы по надзору в сфере здравоохранения и социального развития, и включает в себя следующие сведения:
- наименование новой медицинской технологии;
- аннотацию новой медицинской технологии
- наименование и организационно-правовую форму либо фамилию, имя, отчество (по применимости) и адреса организации-разработчика, автора новой медицинской технологии и лиц, на имя которых выдается разрешение на применение новой медицинской технологии;
- класс потенциального риска применения новой медицинской технологии;
- реквизиты разрешения на применение новой медицинской технологии;
- основания и срок приостановления действия решения о выдаче разрешения на применение новой медицинской технологии;
- основание и дату отзыва разрешения о применении новой медицинской технологии.
3.7.2. В течение 2 рабочих дней с даты поступления соответствующих сведений начальник отдела, осуществляющего выдачу разрешений на применение новых медицинских технологий, или лицо, им назначенное (ответственный исполнитель), вводят их в электронную базу данных выданных разрешений и архивирует ее.
3.7.3. Основанием ведения электронной базы данных выданных разрешений на применение новых медицинских технологий являются документы, которые представляют собой архив на бумажных носителях и включают в себя следующие документы или их копии:
заявления и документы, представленные для получения разрешения на применение новых медицинских технологий, для внесения изменений в выданные разрешения, документы, связанные с проведением мероприятий по контролю соблюдения требований законодательства Российской Федерации при проведении клинических и биомедицинских исследований новой медицинской технологии, а также ее использованием, приостановлением решения о выдаче разрешения на применение новой медицинской технологии, отзывом разрешений на применение новых медицинских технологий.
Указанные документы хранятся в Федеральной службе по надзору в сфере здравоохранения и социального развития.
3.7.4. На официальном Интернет-сайте: www.roszdravnadzor.ru в открытом доступе должны размещаться и ежемесячно обновляться следующие сведения из электронной базы данных выданных разрешений на применение новых медицинских технологий:
- наименование, организационно-правовая форма и местонахождение лиц на имя которых выдано разрешение на применение новой медицинской технологии;
- номер разрешения на применение новой медицинской технологии;
- сведения о приостановлении решений о выдаче разрешения на применение новой медицинской технологии и об отзыве разрешений.
3.7.5. Контроль ведения базы данных выданных разрешений на применение новых медицинских технологий осуществляет начальник отдела, осуществляющего выдачу разрешений на применение новых медицинских технологий.
Приложение 1
к Административному регламенту
по исполнению государственной функции
по выдаче разрешений на применение
новых медицинских технологий
к Административному регламенту
по исполнению государственной функции
по выдаче разрешений на применение
новых медицинских технологий
 | |
| 3189 × 1907 пикс. Открыть в новом окне | |
Приложение 2
к Административному регламенту
по исполнению государственной функции
по выдаче разрешений на применение
новых медицинских технологий
к Административному регламенту
по исполнению государственной функции
по выдаче разрешений на применение
новых медицинских технологий
 | |
| 3199 × 1964 пикс. Открыть в новом окне | |
Приложение 3
к Административному регламенту
по исполнению государственной функции
по выдаче разрешений на применение
регистрации новых медицинских технологий
к Административному регламенту
по исполнению государственной функции
по выдаче разрешений на применение
регистрации новых медицинских технологий
Структура изложения медицинской технологии
Структура изложения новой медицинской технологии (МТ)
┌──────────────────────┬────────────────────────────────────────────────┐
│Титульный лист │ Полное наименование Заявителя (с указанием│
│ │ведомственной принадлежности (при наличии), ниже│
│ │- юридический адрес); │
│ │ Название МТ (по центру титульного листа);│
│ │под названием МТ - в круглых скобках - вид│
│ │документа (медицинская технология). │
├──────────────────────┼────────────────────────────────────────────────┤
│Обратная сторона│ Аннотация: краткое описание МТ, информация о│
│титульного листа │наиболее значимых преимуществах МТ (не более 10│
│ │- 15 строк); перечень врачей-специалистов,│
│ │которым адресована данная МТ и требования к их│
│ │квалификации, дополнительной специализации (при│
│ │необходимости); рекомендуемый уровень/масштаб│
│ │использования МТ. При наличии патентной защиты:│
│ │номер, название, дата выдачи документа,│
│ │патентообладатель/заявитель, │
│ │разработчик/соразработчики (при наличии); Авторы│
│ │МТ; указание организации (организаций), на│
│ │которую(ые) выдается разрешение на применение│
│ │новой медицинской технологии. │
├──────────────────────┼────────────────────────────────────────────────┤
│Разделы описания │Содержание разделов описания медицинской│
│медицинской │технологии │
│технологии │ │
├──────────────────────┼────────────────────────────────────────────────┤
│Введение │ Содержит вводную информацию по решаемой│
│ │проблеме; сведения об используемых аналогичных│
│ │МТ (при наличии), научное обоснование механизмов│
│ │и сущности действия настоящей МТ, применении МТ│
│ │за рубежом (со ссылками на источники│
│ │информации); может включать очерченный круг│
│ │проблем, которые позволит решить внедрение│
│ │данной МТ в практическое здравоохранение. │
├──────────────────────┼────────────────────────────────────────────────┤
│Показания к│ Перечень (по пунктам) заболеваний, симптомов,│
│использованию новой│состояний организма человека, клинических│
│медицинской технологии│ситуаций, при которых показано применение данной│
│ │МТ. │
├──────────────────────┼────────────────────────────────────────────────┤
│Противопоказания к│ Перечень (по пунктам) относительных и│
│использованию новой│абсолютных противопоказаний к использованию│
│медицинской технологии│данной МТ. Для диагностических МТ│
│ │противопоказаниями являются заболевания,│
│ │симптомы, состояния организма человека,│
│ │клинические ситуации, снижающие точность и│
│ │чувствительность МТ, повышающие вероятность│
│ │получения ложноположительных и/или│
│ │ложноотрицательных результатов. │
├──────────────────────┼────────────────────────────────────────────────┤
│Материально-техничес- │ Перечень используемых для осуществления│
│кое обеспечение новой│медицинской технологии лекарственных средств,│
│медицинской технологии│изделий медицинского назначения и др. средств (с│
│ │указанием номера государственной регистрации или│
│ │иного разрешительного документа,│
│ │организации-изготовителя, страны-производителя).│
│ │Все задействованные в МТ средства должны быть│
│ │разрешены к применению в медицинской практике на│
│ │территории РФ в установленном порядке. │
├──────────────────────┼────────────────────────────────────────────────┤
│Описание новой│ Содержит подробно описываемую│
│медицинской технологии│последовательность осуществления медицинской│
│ │технологии; может состоять из подразделов. При│
│ │необходимости сопровождения описания схемами,│
│ │фотографиями, рисунками, таблицами, графиками,│
│ │клиническими примерами и др., облегчающими│
│ │практическое использование предлагаемой МТ│
│ │(должны быть ссылки по тексту на соответствующие│
│ │приложения к МТ). Описание также включает│
│ │оптимальные критерии по интерпретации│
│ │результатов и оценке полученного врачом│
│ │клинического эффекта при использовании данной МТ│
│ │в практической деятельности. │
├──────────────────────┼────────────────────────────────────────────────┤
│Возможные осложнения и│ Перечень возможных осложнений при│
│способы их устранения │использовании МТ, меры по профилактике│
│ │осложнений, тактика врача при их возникновении.│
│ │Для диагностических технологий - меры по│
│ │предотвращению вероятных ложноположительных│
│ │и/или ложноотрицательных результатов. │
├──────────────────────┼────────────────────────────────────────────────┤
│Эффективность │ Содержит данные о количестве клинических│
│использования новой│наблюдений с краткой характеристикой обследуемых│
│медицинской технологии│групп (по полу, возрасту, нозологии и др.),│
│ │результаты статистической обработки полученных│
│ │данных, подтверждающих медико-социальную│
│ │эффективность по использованным разработчиком│
│ │критериям (например, выздоровление,│
│ │продолжительность и качество жизни, частоту│
│ │возникновения отдаленных осложнений - для│
│ │лечебных МТ; влияние на степень трудовой,│
│ │медицинской и социальной реабилитации,│
│ │продолжительность жизни без рецидивов,│
│ │длительность реабилитационного периода,│
│ │инвалидизацию и др. - для реабилитационных МТ;│
│ │точность, специфичность, чувствительность и др.│
│ │- для диагностических МТ), оцененную│
│ │экономическую эффективность (влияние на│
│ │количество койко-дней, стоимость диагностики│
│ │лечения и др.), преимущества перед существующими│
│ │аналогичными МТ. │
├──────────────────────┼────────────────────────────────────────────────┤
│Список литературы │ Список используемых источников в порядке их│
│ │упоминания в тексте МТ (объем не более 1│
│ │страницы) │
├──────────────────────┼────────────────────────────────────────────────┤
│Приложения │ Схемы, фотографии, рисунки, таблицы, графики,│
│ │клинические примеры, облегчающие практическое│
│ │использование предлагаемой МТ располагаются и│
│ │нумеруются в порядке их упоминания в тексте МТ. │
└──────────────────────┴────────────────────────────────────────────────┘
Приложение 4
к Административному регламенту
по исполнению государственной функции
по выдаче разрешений на применение
новых медицинских технологий
к Административному регламенту
по исполнению государственной функции
по выдаче разрешений на применение
новых медицинских технологий
 | |
| 3146 × 1884 пикс. Открыть в новом окне | |
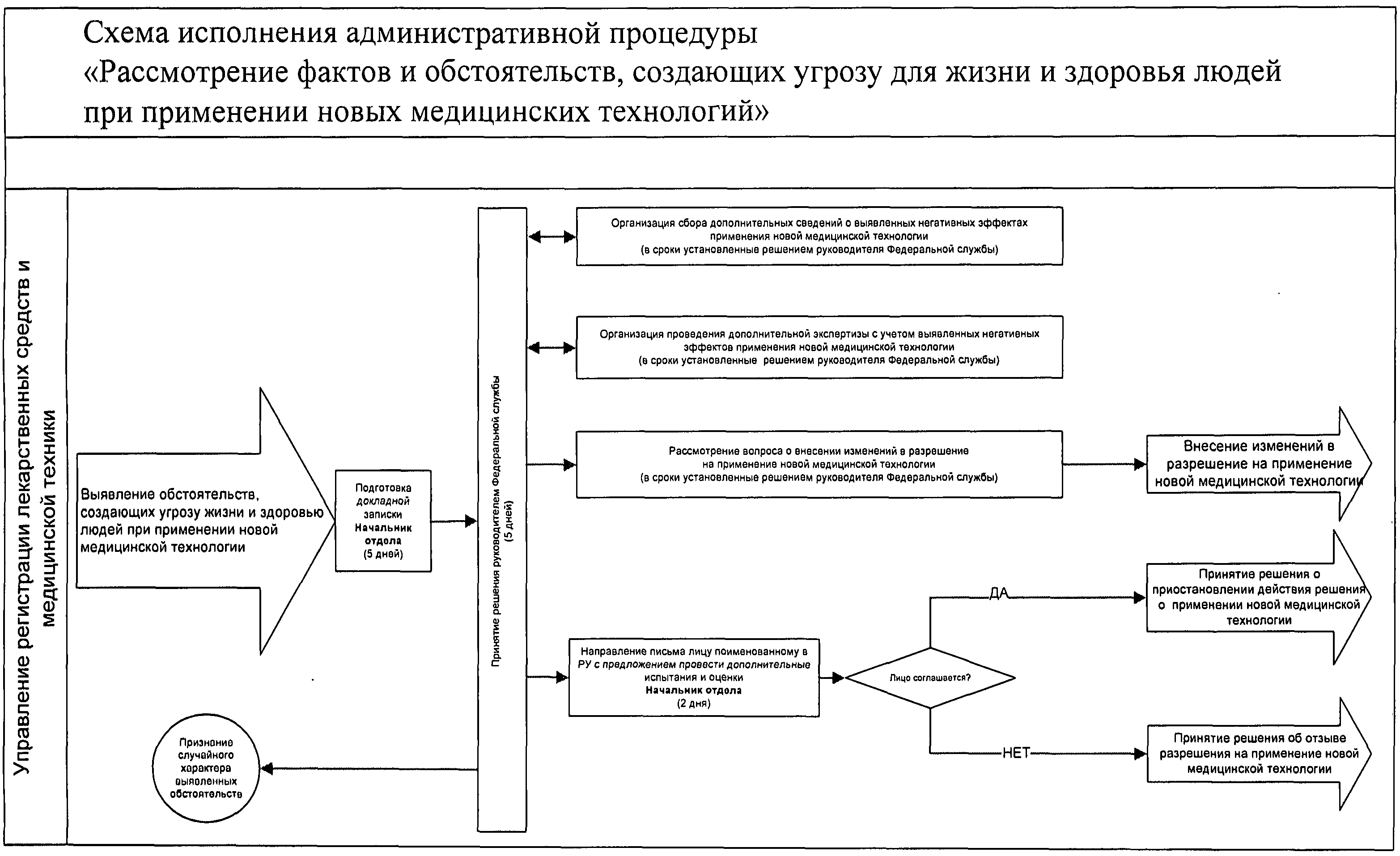
Приложение 5
к Административному регламенту
по исполнению государственной функции
по выдаче разрешений на применение
новых медицинских технологий
к Административному регламенту
по исполнению государственной функции
по выдаче разрешений на применение
новых медицинских технологий
 | |
| 3130 × 1914 пикс. Открыть в новом окне | |
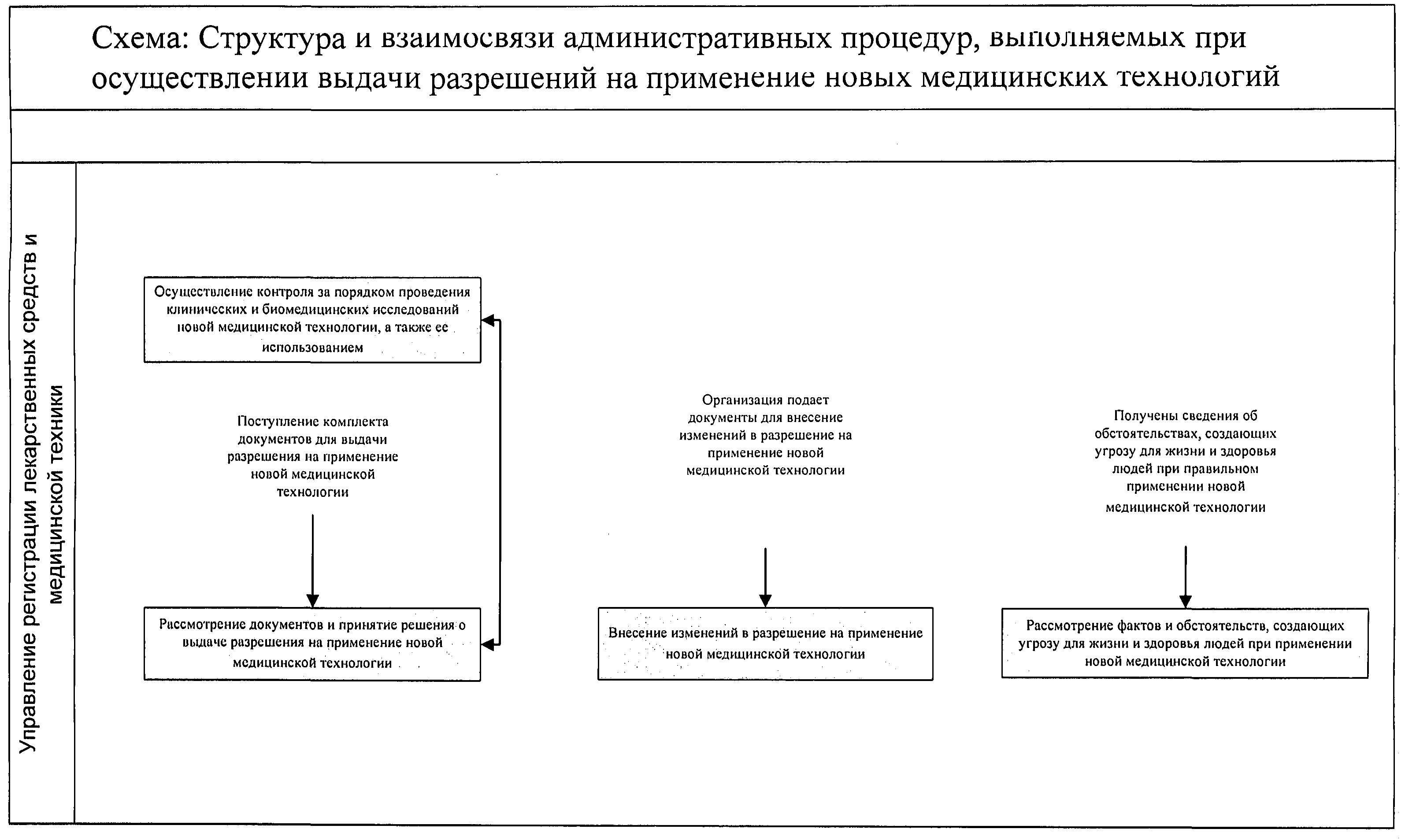
Приложение 6
к Административному регламенту
по исполнению государственной функции
по выдаче разрешений на применение
новых медицинских технологий
к Административному регламенту
по исполнению государственной функции
по выдаче разрешений на применение
новых медицинских технологий
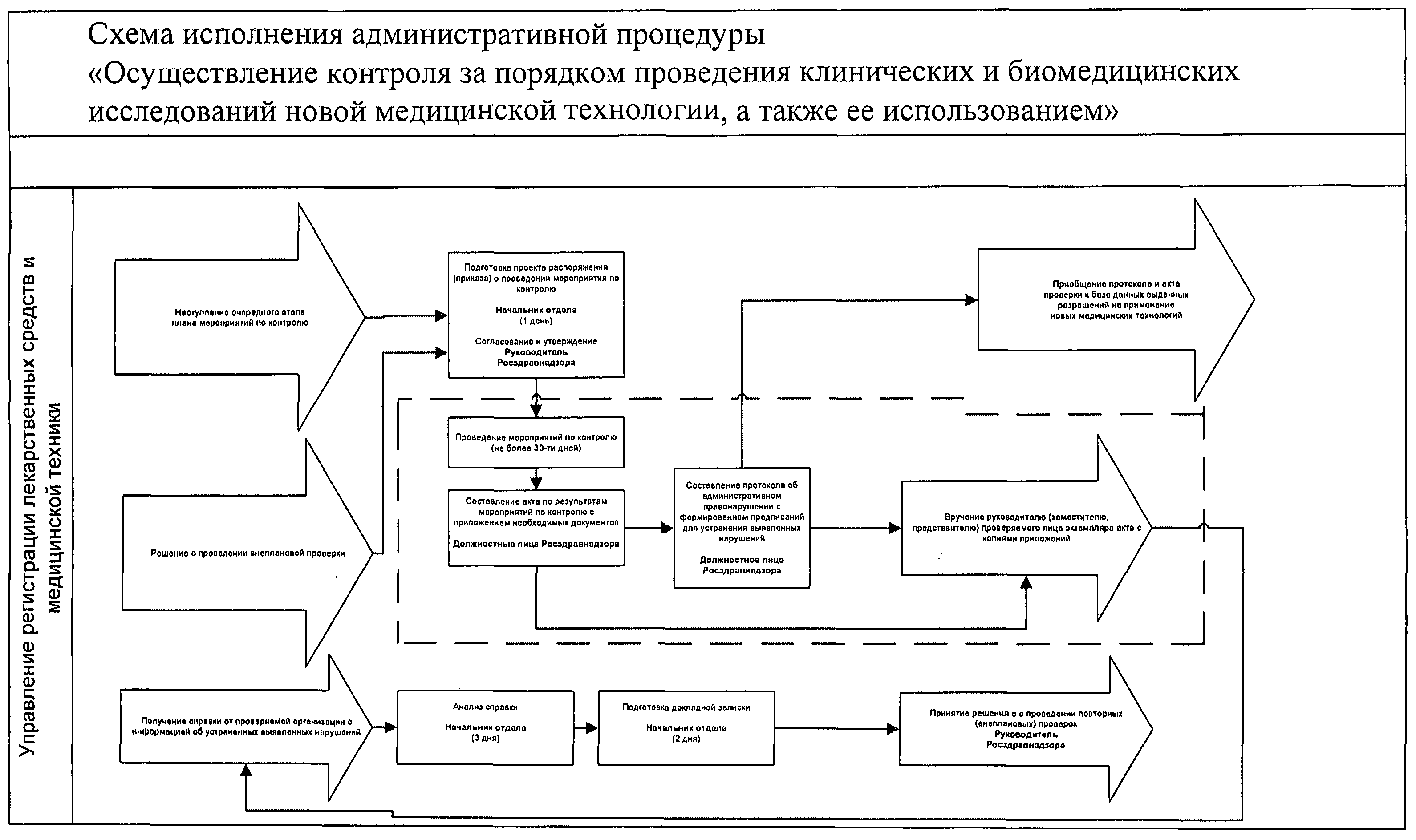 | |
| 3181 × 1888 пикс. Открыть в новом окне | |
Приложение 7
к Административному регламенту
по исполнению государственной функции
по выдаче разрешений на применение
новых медицинских технологий
к Административному регламенту
по исполнению государственной функции
по выдаче разрешений на применение
новых медицинских технологий
 | |
| 3044 × 1892 пикс. Открыть в новом окне | |
